Khi nghiên cứu tính chất của chất khí các nhà khoa học đã phát hiện ra nhiều mối quan hệ đặc biệt giữa các đại lượng như áp suất, thể tích với nhiệt độ. Một trong những định luật nền tảng giúp giải thích rõ ràng mối quan hệ giữa áp suất với nhiệt độ khi thể tích không thay đổi chính là định luật Gay Lussac. Là kiến thức quan trọng không chỉ trong học thuật mà còn có giá trị thực tiễn trong nhiều lĩnh vực kỹ thuật với công nghiệp với đời sống hàng ngày. Bài viết này sẽ giới thiệu chi tiết về định luật Gay Lussac, nguyên lý hoạt động, cách áp dụng cùng những ví dụ thực tế giúp người học hiểu sâu vận dụng hiệu quả.
Khái niệm định luật Gay Lussac
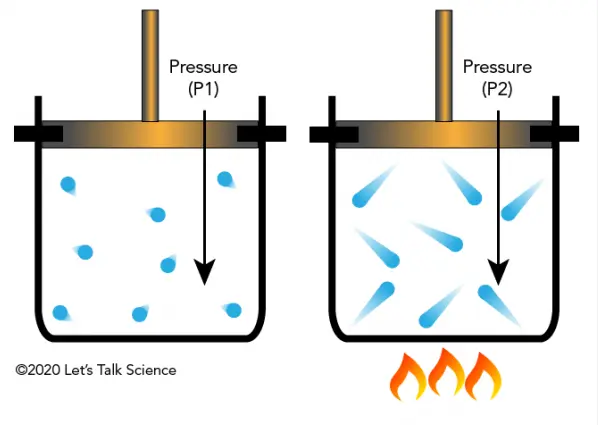
Định luật Gay Lussac phát biểu rằng trong điều kiện thể tích không đổi áp suất của một lượng khí nhất định tỉ lệ thuận với nhiệt độ tuyệt đối của nó. Nghĩa là nếu nhiệt độ tăng áp suất cũng tăng và ngược lại. Nhiệt độ ở đây phải được đo theo thang độ Kelvin vì chỉ có thang này đảm bảo mối quan hệ tỉ lệ thuận tuyến tính giữa áp suất với nhiệt độ.
Mối quan hệ này thường được biểu diễn bằng tỉ số áp suất chia cho nhiệt độ ở trạng thái ban đầu bằng tỉ số áp suất chia cho nhiệt độ ở trạng thái sau. Nếu viết đơn giản thì có thể hiểu là P chia cho T là hằng số khi thể tích không thay đổi.
Cơ sở lý thuyết của định luật
Theo lý thuyết động học phân tử khí bao gồm rất nhiều phân tử chuyển động hỗn loạn không ngừng. Khi nhiệt độ của khí tăng vận tốc trung bình của các phân tử tăng lên dẫn đến số lần từ đó lực va chạm vào thành bình cũng tăng. Kết quả là áp suất tác động lên thành bình tăng lên. Ngược lại khi giảm nhiệt độ chuyển động của phân tử chậm lại số lần va chạm giảm áp suất giảm tương ứng. Chỉ đúng khi thể tích bình chứa khí không thay đổi tức là không có không gian để khí giãn nở hay bị nén lại.
Ứng dụng của định luật Gay Lussac trong thực tế
Định luật Gay Lussac có nhiều ứng dụng thực tiễn trong đời sống hàng ngày cũng như trong các ngành kỹ thuật với công nghiệp.
Một trong những ví dụ rõ ràng nhất là khi sử dụng bình gas hay bình khí nén. Khi để bình khí dưới ánh nắng mặt trời hay môi trường có nhiệt độ cao khí bên trong nóng lên dẫn đến áp suất trong bình tăng. Nếu không có cơ chế xả áp hay kiểm soát nhiệt độ áp suất tăng quá mức có thể dẫn đến nổ bình gây nguy hiểm.
Tương tự trong các thiết bị bình xịt hay bình cứu hỏa định luật Gay Lussac cũng được sử dụng để tính toán lượng khí cần thiết để đẩy chất lỏng ra ngoài khi nhiệt độ môi trường thay đổi.
Trong lĩnh vực hàng không khi máy bay lên cao lúc này nhiệt độ với áp suất thay đổi mạnh. Các kỹ sư cần áp dụng định luật này để thiết kế hệ thống điều áp đảm bảo an toàn cho hành khách.
Trong y học khí y tế như oxy nén cũng phải được bảo quản sử dụng trong điều kiện nhiệt độ thích hợp. Việc tăng giảm nhiệt độ đột ngột có thể làm thay đổi áp suất khí gây nguy cơ nguy hiểm cho bệnh nhân nếu không kiểm soát đúng cách.
Ví dụ minh họa
Giả sử có một bình chứa khí với áp suất ban đầu là 300 kilopascal tại nhiệt độ 27 độ C. Nếu nhiệt độ tăng lên 57 độ C hãy tính áp suất mới của khí biết rằng thể tích không thay đổi.
Đầu tiên chuyển đổi nhiệt độ sang đơn vị Kelvin bằng cách cộng thêm 273. Ta có nhiệt độ ban đầu là 300 Kelvin với nhiệt độ sau là 330 Kelvin.
Áp dụng định luật Gay Lussac ta có tỉ lệ P1 chia T1 bằng P2 chia T2. Thay số vào ta được
300 chia 300 bằng P2 chia 330. Giải phương trình ta có P2 bằng 330 kilopascal.
Như vậy khi nhiệt độ tăng 30 độ C áp suất cũng tăng thêm 30 kilopascal minh chứng cho mối quan hệ tỉ lệ thuận giữa hai đại lượng.
Giải bài tập áp dụng
Một bài toán cơ bản thường gặp trong chương trình phổ thông như sau
Một bình kín chứa khí có áp suất 2 atm tại nhiệt độ 300 Kelvin. Bình được làm nóng đến 450 Kelvin. Tính áp suất mới của khí nếu thể tích không thay đổi.
Áp dụng công thức ta có P2 bằng P1 nhân T2 chia T1 tức là 2 nhân 450 chia 300 bằng 3 atm. Như vậy áp suất tăng 1.5 lần khi nhiệt độ tăng từ 300 lên 450 Kelvin.
Bài tập dạng này không chỉ giúp học sinh luyện kỹ năng tính toán còn giúp hình dung được tác động thực tế của nhiệt độ lên áp suất khí.
Hạn chế, điều kiện áp dụng
Định luật Gay Lussac chỉ đúng trong điều kiện khí lý tưởng nghĩa là các phân tử khí không tương tác với nhau chiếm thể tích không đáng kể. Trong thực tế các khí như khí hóa lỏng hay khí ở áp suất cao có thể không tuân theo định luật hoàn toàn chính xác. Khi đó cần áp dụng các mô hình phức tạp hơn như phương trình khí thực Van Der Waals.
Ngoài ra định luật chỉ áp dụng trong điều kiện thể tích không đổi. Nếu thể tích thay đổi thì cần sử dụng phương trình khí lý tưởng đầy đủ hay kết hợp với các định luật khác như định luật Boyle hay định luật Charles.
Định luật Gay Lussac là một phần không thể thiếu trong hệ thống các định luật khí lý tưởng. Mô tả rõ ràng mối quan hệ giữa áp suất với nhiệt độ của khí trong điều kiện thể tích không đổi. Định luật không chỉ là công cụ học tập hiệu quả còn là cơ sở khoa học cho nhiều ứng dụng trong đời sống công nghiệp. Việc hiểu với vận dụng đúng định luật này sẽ giúp người học nâng cao khả năng giải quyết bài tập ứng dụng kiến thức một cách thực tế mà hiệu quả. Đây là bước quan trọng trong việc xây dựng nền tảng vững chắc về vật lý với hóa học ứng dụng.