Bảng tuần hoàn nguyên tố hóa học
Cách đọc bảng tuần hoàn hóa học
Bảng tuần hoàn bắt đầu ở phía trên bên trái và kết thúc ở cuối hàng cuối cùng, gần phía dưới bên phải. Bảng có cấu trúc từ trái sang phải theo chiều tăng dần của số hiệu nguyên tử. Số hiệu nguyên tử chính là số proton trong một nguyên tử.
- Không phải hàng hay cột nào cũng chứa đủ các nguyên tố. Mặc dù có thể có khoảng trống ở giữa, nhưng ta vẫn tiếp tục đọc bảng tuần hoàn từ trái sang phải. Ví dụ, hiđro có số hiệu nguyên tử là 1 và nó ở phía trên bên trái. Heli có số hiệu nguyên tử là 2 và nó ở phía trên bên phải.
- Nguyên tố 57 đến nguyên tố 102 được xếp thành một bảng nhỏ ở dưới cùng bên phải của bảng. Chúng là “các nguyên tố đất hiếm”.

Tìm một “nhóm” nguyên tố trong mỗi cột của bảng tuần hoàn. Chúng ta có 18 cột.
- Trong một nhóm thì ta đọc từ trên xuống dưới.
- Số nhóm được đánh ở trên các cột; tuy nhiên, một vài nhóm khác được đánh số ở dưới, như nhóm kim loại.
- Cách đánh số trên bảng tuần hoàn có thể rất khác nhau. Người ta có thể sử dụng chữ số La Mã (IA), chữ số Ả Rập (1A), hoặc số từ 1 đến 18.
- Hiđro có thể được xếp trong nhóm halogen hay nhóm kim loại kiềm, hoặc cả hai.
Tìm “chu kì” của nguyên tố trong mỗi hàng của bảng tuần hoàn. Chúng ta có 7 chu kì. Trong một chu kỳ thì ta đọc từ trái sang phải.
- Chu kì được đánh số từ 1 đến 7 ở bên trái của bảng.
- Chu kỳ sau sẽ lớn hơn chu kỳ trước. Khái niệm lớn ở đây nghĩa là mức năng lượng của nguyên tử tăng dần trên bảng tuần hoàn.
Hiểu cách phân nhóm bổ sung theo kim loại, bán kim loại và phi kim. Màu sắc sẽ thay đổi rất nhiều.
- Kim loại sẽ được tô cùng một màu. Tuy nhiên, hiđro thường được tô cùng màu với phi kim và được nhóm với phi kim. Kim loại có ánh kim, thường ở trạng thái rắn ở nhiệt độ phòng, có tính dẫn nhiệt và dẫn điện, dẻo và dễ uốn.
- Phi kim được tô cùng một màu. Chúng là các nguyên tố từ C-6 đến Rn-86, bao gồm H-1 (Hiđro). Phi kim không có ánh kim, không dẫn nhiệt hoặc dẫn điện và không có tính dẻo. Chúng thường ở trạng thái khí ở nhiệt độ phòng và có thể ở trạng thái rắn, khí hoặc lỏng.
- Bán kim loại/á kim thường được tô màu tím hoặc xanh lá cây, là sự kết hợp của 2 màu khác. Đường chéo trải dài từ nguyên tố B-5 đến At-85 là đường ranh giới. Chúng có một số tính chất của kim loại và một số tính chất của phi kim.

Đọc ký hiệu hóa học và tên nguyên tố

Đọc ký hiệu hóa học trước. Đó là sự kết hợp của 1 đến 2 chữ cái được sử dụng thống nhất trong các ngôn ngữ.
- Ký hiệu hóa học bắt nguồn từ tên Latinh của nguyên tố đó hoặc tên thông thường được phổ biến rộng rãi.
- Trong nhiều trường hợp, ký hiệu hóa học bắt nguồn từ tên tiếng Anh, như trường hợp heli là “He”. Tuy nhiên, đây không phải là quy tắc thống nhất trong hóa học. Ví dụ, sắt (iron) là “Fe”. Vì lý do này, bạn phải ghi nhớ cả ký hiệu hóa học/tên để nhận biết nhanh nguyên tố.
-
 Tìm tên thông thường của nguyên tố. Tên nguyên tố nằm ở dưới ký hiệu hóa học. Nó sẽ thay đổi phụ thuộc vào ngôn ngữ của bảng tuần hoàn.
Tìm tên thông thường của nguyên tố. Tên nguyên tố nằm ở dưới ký hiệu hóa học. Nó sẽ thay đổi phụ thuộc vào ngôn ngữ của bảng tuần hoàn.
Đọc số hiệu nguyên tử




Tìm ra số proton trong nguyên tử cũng như tìm được số electron trong nguyên tử đó. Nguyên tử có số electron và số proton bằng nhau.
- Lưu ý rằng có một ngoại lệ trong quy tắc này. Nếu nguyên tử mất hoặc nhận electron, nó trở thành một ion tích điện.
- Nếu có dấu cộng bên cạnh ký hiệu hóa học của nguyên tố thì đó là điện tích dương. Nếu là dấu trừ thì đó là điện tích âm.
- Nếu không có dấu cộng hoặc dấu trừ và bài toán hóa học không liên quan đến ion thì bạn có thể xem số proton bằng với số electron.
Đọc trọng lượng nguyên tử

Tìm trọng lượng nguyên tử. Đây là con số bên dưới tên nguyên tố.
- Mặc dù dường như trọng lượng nguyên tử tăng dần từ góc trái bên trên sang góc phải bên dưới, nhưng điều này không phải lúc nào cũng đúng.


Dùng trọng lượng nguyên tử để tìm số nơtron trong nguyên tử. Làm tròn trọng lượng nguyên tử đến số nguyên gần nhất sẽ được nguyên tử khối. Sau đó, bạn lấy nguyên tử khối trừ đi số proton để có số nơtron.
- Ví dụ, trọng lượng nguyên tử của sắt là 55,847, vì vậy nguyên tử khối là 56. Nguyên tử này có 26 proton. 56 (nguyên tử khối) trừ đi 26 (proton) bằng 30. Nghĩa là trong một nguyên tử sắt thường có 30 nơtron.
- Thay đổi số nơtron trong nguyên tử sẽ tạo thành các đồng vị, là các biến thể của nguyên tử có nguyên tử khối nặng hay nhẹ hơn.
Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn nguyên tố hóa học đầy đủ nhất
– Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
– Các nguyên tố có cùng số lớp electron trong nguyên tử sẽ được xếp thành một hàng ở chu kì
– Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Bảng nguyên tử khối và cấu tạo bảng tuần hoàn nguyên tố hóa học đầy đủ nhất
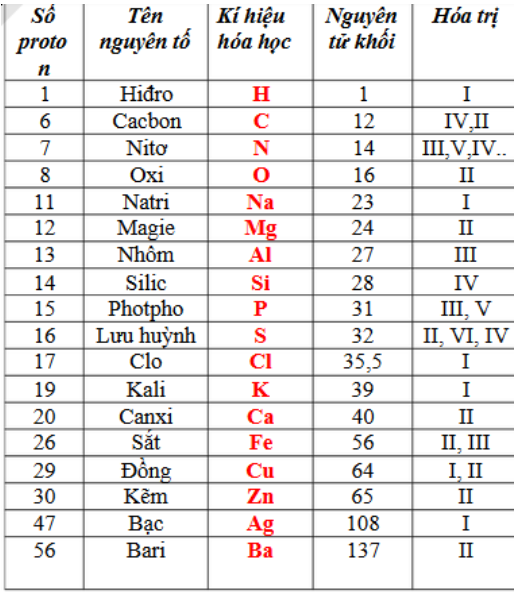
1.Bảng nguyên tử khối
2. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).
3. Chu kì
Chu kì là dãy của các nguyên tố mà nguyên tử của chúng cùng số lớp electron và sẽ được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.
4. Nhóm nguyên tố
– Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
– Chỉ có 2 loại nhóm nguyên tố đó là nhóm A và nhóm B:
+ Nhóm A sẽ bao gồm các nguyên tố s và p.
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B sẽ bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
III. Quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử của nó
Các cấu hình electron trong nguyên tử và vị trí của các nguyên tố đó trong bảng tuần hoàn có mối quan hệ qua lại với nhau.
– Số thứ tự của ô nguyên tố = tổng số e của nguyên tử
– Số thứ tự của chu kì = số lớp e
+ Nếu cấu hình e lớp ngoài cùng có dạng nsansp thì nguyên tố thuộc nhóm (a+b) A
+ Nếu cấu hình e kết thúc ở dạng (n-1)dxnsy thì nguyên tố thuộc nhóm B:
Nhóm (x+y)B nếu 3 ≤ (x + y) ≤ 7.
Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
Nhóm (x + y – 10)B nếu 10 < (x + y).
IV. Quan hệ giữa vị trí và tính chất của nguyên tố
Vị trí nguyên tố cho biết:
– Các nguyên tố thuộc nhóm (IA, IIA, IIIA) trừ B và H có tính kim loại. Các nguyên tố thuộc nhóm VA, VIA, VIIA có tính phi kim (trừ Antimon, bitmut, poloni).
– Hoá trị cao nhất của nguyên tố với oxi, hóa trị với hiđro.
– Công thức của oxit cao nhất và hidroxit tương ứng
– Công thức của hợp chất khí với H (nếu có)
– Oxit và hidroxit sẽ có tính axit hay bazo.
Ví dụ: Cho biết S ở ô thứ 16 suy ra:
– Hoá trị cao nhất với oxi 6, với hiđro là 2.
– CT oxit cao nhất SO3, h/c với hiđro là H2S.
– SO3 là ôxit axit và H2SO4 là axit mạnh.
V. So sánh tính chất hoá học của một nguyên tố với các nguyên tố lân cận
a. Trong chu kì theo chiều tăng của điện tích hạt nhân:
– Tính kim loại yếu dần, tính phi kim mạnh dần.
– Tính bazơ, của oxit và hiđroxit yêú dần, tính axit mạnh dần.
b. Trong nhóm A theo chiều tăng của điện tích hạt nhân:
Tính kim loại mạnh dần, tính phi kim yếu dần.
* Lưu ý khi xác định vị trí các nguyên tố nhóm B .
– Nguyên tố họ d : (n-1)dansbvới a = 1 → 10 ; b = 1 → 2
+ Nếu a + b < 8 ⇒ a + b là số thứ tự của nhóm .
+ Nếu a + b > 10 ⇒ (a + b) – 10 là số thự tự của nhóm.
+ Nếu 8 ≤ a + b ≤ 10 ⇒ nguyên tố thuộc nhóm VIII B
– Nguyên tố họ f : (n-2)fansbvới a = 1 → 14 ; b = 1 → 2
+ Nếu n = 6 ⇒ Nguyên tố thuộc họ lantan.
+ Nếu n = 7 ⇒ Nguyên tố thuộc họ acti
Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f
e cuối cùng điền vào phân lớp nào ( theo thứ tự mức năng lượng ) thì nguyên tố thuộc khối đó
Đặc biệt nguyên tố H hiện nay được xếp ở vị trí là ngón IA và VIIA đều ở chu kì 1. Nguyên tố He mặc dù có 2e lớp ngoài cùng nhưng được xếp ở nhóm VIIIA. Điều này hoàn toàn phù hợp vì H giống kim loại kiềm đều có 1e ở lớp ngoài cùng nhưng nó cũng giống các halogen vì chỉ thiếu 1e nữa là đạt cấu hình bền giống khí hiếm He: còn He mặc dù có 2e ở lớp ngoài cùng nhưng giống các khí hiếm khác là cấu hình e đó là bão hòa
tag: baảng pdf 9 lop sơ lược luật download file word bang chuyên đề full hd hoc bản